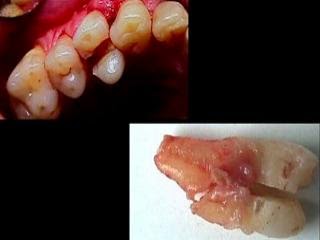
sábado, 29 de noviembre de 2014
COMPLICACIONES QUE SE PUEDEN PRESENTAR AL REALIZAR UNA EXODONCIAS DENTAL
Definimos una exodoncia como el acto
quirúrgico mediante el cual se extraen los dientes erupcionados de sus
alvéolos, con el menor trauma y dolor posible, por tanto al ser considerado un
acto quirúrgico no estamos exentos de que se tengan complicaciones. En el
siguiente blog se describirán las principales complicaciones que se pudieran
presentar durante una extracción dentaria, con el fin de que se tenga el
conocimiento y se puedan prevenir o tratar.
Complicación
Fenómeno que
sobreviene en el curso de un procedimiento quirúrgico, distinto de las
manifestaciones habituales de este y consecuencia de las lesiones provocadas
por él. Agravando generalmente el pronóstico.
Las complicaciones
se pueden dividir en:
·
Inmediatas
·
Mediatas
Complicaciones Inmediatas
1.
FRACTURAS
El accidente más
común durante la exodoncia con fórceps es la fractura del diente, ya sea de la
corona o de su raíz
Factores:
·
Tratamiento endodóncico previo.
·
Anquilosis de la raíz dentaria en el hueso
alveolar.
·
Hipercementosis.
·
Grandes destrucciones coronarias.
·
Hueso denso o esclerótico.
·
Raíces largas, puntiagudas, curvas y divergentes.
·
Acceso inadecuado.
2. Luxación o fractura del diente
contiguo
La subluxación del
diente contiguo se puede producir por una incorrecta aplicación de los
elevadores que transmiten la fuerza del brazo de palanca al diente adyacente
con lo que se consigue el aflojamiento de éste.
Si la movilidad es
mayor se deberá realizar su ferulización con los dientes vecinos durante 2 a 4
semanas y controlar la vitalidad.
Se puede producir
cuando el fórceps o el botador resbala y lo golpea, o también por ejercer una
fuerza excesiva contra él con un elevador mal colocado.
Dientes o raíces desplazados a los
espacios anatómicos vecinos
Ocurre por
maniobras violentas o por un Movimiento
intempestivo del paciente.
·
Puede producirse:
·
Hacia cualquier espacio anatómico vecino.
·
Hacia el conducto dentario inferior
·
Hacia el seno maxilar
·
Hacia la vía digestiva.
·
Hacia la vía respiratoria.
Estos
desplazamientos hacia los espacios anatómicos vecinos se producen por la
perforación de las corticales vestibular o lingual/palatina.
Esta raíz tiende a
desplazarse hacia abajo, lo que dificulta su localización y extracción.
Resolveremos estos
casos con un abordaje quirúrgico específico para realizar su exéresis siempre
con un estudio radiológico previo para localizar correctamente la raíz o el
diente.
3. Tejidos duros
Fracturas del hueso alveolar
Suele ser relativamente frecuente al realizar una
extracción dentaria.
Puede suceder que el hueso alveolar fracturado se
desprenda por completo o que quede adherido al periostio.
Pero si el fragmento óseo ha perdido más de la
mitad de su fijación perióstica, deberemos eliminarlo.
Esta eventualidad podrá ser solucionada con
distintas técnicas: injertos de hueso.
Si en el hueso alveolar quedan espículas de hueso
o zonas puntiagudas, deberemos regularizar el alvéolo.
Fractura de la tuberosidad.
La mala aplicación de los elevadores o de algún
tipo de fórceps son sus causas principales.
Esta complicación puede ser resultado de la
invasión antral de la tuberosidad, hecho común cuando está presente un molar
superior aislado, en particular si tiene raíces divergentes, hipercementosis o
presenta sobreerupción. Otra causa predisponente poco común es la geminación patológica
que ocurre entre el segundo molar superior y el tercero erupcionado o
semierupcionado.
Cuando se produce la fractura, que frecuentemente
se acompaña de una hemorragia importante, debemos parar la extracción y
preparar un colgajo mucoperióstico vestibular amplio; se liberará la
tuberosidad fracturada y el diente de los tejidos blandos
Posteriormente extraeremos ambas y realizaremos la
sutura de los tejidos blandos.
Si se produce una comunicación bucosinusal y el
seno maxilar está sano, es suficiente con alisar los bordes óseos y suturar la
encía.
Si el seno maxilar está infectado, se debe hacer
una antrostomía nasal y es posible que deba realizarse posteriormente una
intervención de Caldwell- Luc, y al mismo tiempo un colgajo vestibular o/y
palatino para el cierre mucoso de la comunicación.
Fractura mandibular
Es una complicación muy poco frecuente
Se produce en las extracciones de los terceros
molares inferiores, especialmente si están en inclusión intraósea profunda a
nivel del ángulo mandibular
En los premolares inferiores donde el grosor de la
mandíbula puede estar reducido por una gran reabsorción ósea.
Cuando se aplica una fuerza de forma inadecuada o
con una potencia excesiva.
Son posibles cuando existe alguna alteración
patológica del hueso maxilar, como la presencia de grandes quistes, tumores, en
trastornos generales del paciente, como la osteoporosis senil, alteraciones del
metabolismo del calcio, etc., atrofia, osteomielitis o radioterapia previa.
Se debe actuar de forma adecuada para prevenir
esta posibilidad. Deberá referirse el paciente inmediatamente a un centro
especializado y realizarse:
Extracción del diente incluido contenido en el
foco de fractura.
Reducción de la fractura e inmovilización del foco
mediante osteosíntesis con miniplacas de titanio y opcionalmente bloqueo
intermaxilar.
Regularización de los bordes de la herida y sutura
de los tejidos blandos.
Tratamiento antibiótico y sintomático
Luxación de la mandíbula
La luxación puede ser unilateral o bilateral.
Apertura amplia y prolongada de la boca durante
los tratamientos odontológicos, pero en otros casos puede presentarse de forma
recidivante o crónica.
Los pacientes con hiperlaxitud ligamentosa,
medicaciones con efectos extrapiramidales como por ejemplo fenotiacinas y
tranquilizantes mayores, pueden tener una mayor predisposición a padecer
luxaciones.
La luxación anterior bilateral origina la
protusión de la mandíbula con apertura de la boca. El mentón se dirige hacia
abajo y hacia delante.
Si la luxación es unilateral, la mandíbula se
desvía hacia el lado no afecto.
La luxación temporomandibular aguda puede ser
tratada por reducción manual (maniobra de Nelaton o maniobra de Dupuis).
Ello se facilita con la administración simultánea
de relajantes musculares, infiltración periarticular anestésica o sedantes.
4. Complicaciones relacionados con
tejidos blandos
Desgarre de la mucosa
·
Mala técnica quirúrgica.
·
Fuerzas excesivas.
·
Exodoncias complicadas.
Su tratamiento
consiste en la sutura.
Hematomas
Difusión de la sangre
siguiendo planos musculares.
Se caracteriza por
un aumento de volumen a nivel del sitio operado y un cambio de color de la piel
vecina.
Su tratamiento
consiste en colocar bolsa de hielo para disminuir el dolor y la tensión,
sulfamidoterapia y antibióticos.
5. Accidentes en relación con el tejido
nervioso
Nervio dentario inferior.
Es susceptible de ser lesionado a nivel del tercer
molar inferior.
Distintos factores: posición del cordal, longitud
de las raíces, altura y espesor del cuerpo mandibular.
Compresión, desgarro por estiramiento o una herida
del nervio, sección.
Nervio mentoniano
Extracción de las raíces de los premolares
inferiores.
Incisión mucosa en la región premolar.
Alveolectomía.
Avulsión quirúrgica de un diente incluido en esta
región.
No hay nunca repercusión dentaria.
Síntomas no presentan tanta gravedad.
El dolor puede ser muy acentuado.
Nervio lingual
Tercer molar inferior.
No pondremos realizar suturas profundas.
Se ha relacionado con un foco necrótico.
La sección del nervio lingual producirá la
anestesia de la hemilengua.
Lesión del nervio (no sección) producirá
hipoestesia, disestesia y/o hiperestesia.
Trastornos de la gustación.
No hay trastorno alguno de la movilidad.
Nervio nasopalatino y palatino
anterior.
Zona nasopalatina – mesiodens.
Zona palatina entre el segundo o tercer molar.
Sintomatología pasa la mayoría de veces
desapercibida por el propio paciente.
Complicaciones
mediatas
1. Infecciones
Alveolitis
Infección pútrida
del alvéolo dentario después de una extracción, es una complicación frecuente y
molesta y la más engorrosa de la exodoncia.
Se presenta de
maneras diversas:
Formando parte de
inflamaciones óseas más extendidas, osteítis
periostitis óseas, flemones perimaxilares, etc.
Inflamación a
predominio alveolar, con un alvéolo
sangrante y doloroso, alveolitis plástica.
Alveolitis seca,
alvéolo abierto sin coagulo, paredes ósea expuestas dolorosas, tejido gingival
poco infiltrado muy doloroso,
sobre todo en los bordes.
Tratamiento:
Lavado de la cavidad
con un chorro
de suero fisiológico caliente y agua oxigenada.
Suave secado de la
cavidad con gasa esterilizada.
Se introduce en la
cavidad alveolar el alvogil.
También se puede
utilizar el cemento quirúrgico.
Osteítis circunscrita del reborde alveolar
Se da a
consecuencia de un accidente de la exodoncia por ejemplo la extracción de un
diente retenido o un diente normalmente erupcionado que origina la fractura de
las tablas maxilares o el tabique interradicular.
Radiográficamente:
es inconfundible la lesión; pero en algunas ocasiones será necesario tomar una
radiografía de otro ángulo pues la línea de fractura puede pasar inadvertida.
Abscesos
Suelen
deberse a la reacción de focos crónicos dentarios que no han sido eliminados tras la exodoncia, o la infección
por cuerpo extraños como esquirlas óseas, tártaro, restos de obturaciones, etc.
Se observa en
pacientes con las defensas debilitadas-
No es raro
encontrar estas complicaciones e manera tardía, pasadas las 4 o 5 semanas, en
la extracción quirúrgica de los terceros molares inferiores retenidos.
Celulitis
Tumefacción
dolorosa del tejido blando de la boca y la cara, resultante de una propagación
difusa de exudado purulento a lo largo de los planos faciales que separan los
fascículos musculares.
Sinusitis
Se produce en la extracción de dientes antrales
infectados o terceros molares, al producirse una comunicación bucosinusal.
La simple
acumulación de pus en la cavidad sinusal, puede traducirse como un empiema que
debe ser tratado.
2. Hemorragicos
Siempre después de
una intervención quirúrgica, incluidas las exodoncias convencionales, se
deberán dar unas instrucciones; en ellas se explica al paciente que siempre
existe un pequeño sangrado que suele ceder en los 30-60 minutos posteriores.
Hemorragias posoperatorias
Son aquellas que se
presentan después de la exodoncia y que se pueden deber a la existencia de los
siguientes problemas:
Una herida mucosa,
especialmente si los tejidos están inflamados.
Fractura parcial
del hueso alveolar o de espículas óseas que quedan en el interior del alvéolo.
Persistencia de un
ápice fracturado que sigue en su sitio.
La presencia de un
granuloma no cureteado.
Una herida arterial
o venosa.
Enjuagues bucales
efectuados tras la extracción dentaria, succión persistente o aspiración
repetida del alvéolo.
Cercanía de tumores
muy vascularizados como el angioma, los épulis, etc., al lugar de la exodoncia.
Caída prematura de
la escara de un vaso electro coagulado.
Tratamiento
Anestesia.
Limpieza de la
cavidad bucal.
Limpieza de la
cavidad alveolar, con extracción de los coágulos y restos de estructuras óseas
que hayan podido quedar en el alvéolo.
Si existe
infección, daremos un tratamiento antibiótico.
Una vez que conocimos las posibles complicaciones que pueden ocurrir al realizar una extracción, lo que recomiendo es que previo a realizar cualquier procedimiento debemos conocer la técnica y todo lo relacionado al diente a extraer, pues con estos conocimientos sera menos probable que ocurra una complicación durante o después de la extracción.
viernes, 14 de noviembre de 2014
Clasificacion de la ASA en Odontologia
La
Sociedad Americana de Anestesiología (ASA) estableció unos parámetros que
permiten estimar el estado general del paciente en relación al riesgo que
supone la intervención. La mortalidad peroperatoria se correlaciona bien con
los estadios de la ASA
La clasificación
ASA dental es empleada por los dentistas en la clínica dental después de
recoger información médica del paciente para valorar el estado preparatorio del
paciente odontológico y es la siguiente
|
ASA I
|
Paciente sano
|
Paciente sano
|
|
ASA II
|
Enfermedad sistémica grave. Sin
limitación funcional
|
Fumador, Hipertensión controlada, Diabético
controlado.
|
|
ASA III
|
Enfermedad sistémica grave. Con
limitación funcional
|
Cardiópata por isquemia (angina o
infarto) con tolerancia al esfuerzo, Bronquitis crónica con disnea al
esfuerzo.
|
|
ASA IV
|
Enfermedad sistémica grave. Riesgo
de vida para paciente.
|
Bronquitis crónica con disnea en
reposo, Paciente en hemodialisis a espera de trasplante renal
|
|
ASA V
|
Paciente moribundo.
|
|
Es
importante conocer esta clasificación puesto que estamos expuestos a recibir en
el consultorio a cualquier tipo de paciente, con infinidad de enfermedades. Es por
eso debemos considerar las posibles complicaciones y estimar la relación
beneficio-riesgo en el tratamiento que vallamos a realizar a dichos pacientes.
Esta
clasificación nos ayuda a identificar las limitaciones que tenemos con cada
paciente por ejemplo los pacientes ideales para poder ser anestesiados son ASA I,
II y III. En el consultorio privado se recomienda atender hasta una clasificación
ASA III, mientras que la IV se
recomienda atender a nivel hospitalario por cualquier complicación que se
pudiera presentar poder atenderla rápidamente.
Con
esto comprobamos la importancia de esta clasificación en nuestra consulta
diaria, junto con un buen diagnóstico y plan de tratamiento evitara
complicaciones.
Prevención de Endocarditis Infecciosa basado en las guías de la American Heart Asociation (AHA)
PREVENCIÓN
DE ENDOCARDITIS INFECCIOSA BASADO EN LAS GUÍAS DE LA AMERICAN HEART ASOCIATION
(AHA)
En nuestra carrera la endocarditis infecciosa
(EI) tiene una importancia relevante, ya que nosotros de no ser precavidos
podemos ser los causantes de dicha infección. En este texto se describirá la
manera en que se produce y cómo podemos prevenirla o tratarla. Primero
comenzaré definiendo que es la EI.
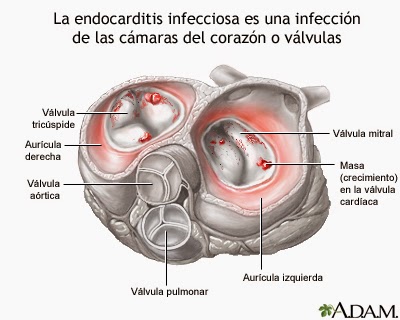
La endocarditis infecciosa
es una infección de la membrana que recubre el interior de las cavidades del
corazón (endocardio) o las válvulas cardíacas.
PATOGENIA:
La EI es el resultado neto de la compleja interacción
entre el patógeno en el torrente sanguíneo con las moléculas matriz y las
plaquetas en los sitios de daño celular endocárdico. La siguiente secuencia de
eventos es considerada resultante de EI: formación de endocarditis trombotica
no bacteriana (ETNB)en la supeficie de la vávula o un lugar donde ocurra el
daño y bacteremia con la adherencia de bacterias en el torrente sanguíneo a
ETNB y proliferación de bacterias.
El
flujo sanguíneo turbulento producido por ciertas enfermedades cardiacas congénitas o adquiridas traumatiza el
endotelio, creando una predisposición
para el depósito de plaquetas y de fibrina en la superficie del endotelio, lo
que resulta en ETNB. La
invasión de especies microbianas al torrente sanguíneo, que tienen el potencial
patogénico de colonizar el sitio, pueden dar como resultado EI.
Las mucosas
están pobladas por una microflora endógena. Un trauma en la mucosa, particularmente las grietas
alrededor de los dientes y en la orofaringe, tracto GI, uretra y
vagina, liberan diferentes especies microbianas en forma transitoria al torrente
circulatorio. La bacteremia transitoria causada por estreptococos del grupo viridans
y de otra microflora oral ocurre comúnmente en asociación con extracciones dentales
u otros procedimientos dentales. Las
especies microbianas que entran en la circulación dependen de la peculiar
microflora endógena que coloniza el sitio traumatizado en particular.
La
capacidad de distintas especies microbianas para adherirse a sitios específicos
determina la localización anatómica de la infección causada por estos
microorganismos.
ž Algunos estreptococos del
grupo viridans contienen una proteína FilmA que tiene un receptor proteico antígeno
I que sirve como una adhesina a la matriz de fibrina de las plaquetas del ETBN.
ž Adhesinas estafilocócicas funcionan
de dos formas:
- componentes de la superficie microbiana reconocen las moléculas de la matriz ahesiva facilitando la adhesión del estafilococo a las proteínas matriz extracelulares humanas.
- . las estructuras bacterianas extracelulares contribuyen a la formación de biopelicula que se forma en las superficies de los dispositivos medico soportados.
Los
MO adherentes a la vegetación estimulan un mayor depósito de fibrina y de
plaquetas en la superficie. Dentro de
este foco los MO se multiplican rápidamente
como las bacterias en los cultivos para alcanzar sus máximas densidades
microbianas. Las vegetaciones del lado
derecho tienen menores densidades bacterianas, que pueden ser la consecuencia
de la actividad de los mecanismos de defensa del huésped, tales como la
actividad polimorfonuclear o las proteínas antibacterianas derivadas de las
plaquetas.
Racionalidad
a favor y en contra de la profilaxis de EI
Hace más de
un siglo, la cavidad oral fue reconocida como una fuente potencial de
bacteremia que causa la EI debida al grupo de estreptococo viridans.
En
1885, se notó una asociación entre la bacteremia debida a cirugía y la EI y reportaron
en 1935 que 11% de los pacientes con higiene oral deficiente tenían cultivos
sanguíneos positivos para estreptococo viridans y que 61% de los pacientes
tenían bacteremia por estreptococo viridans con la extracción dental.
Como
resultado de estos estudios las guias de la AHA recomendaron profilaxis
antimicrobiana para prevenir EI en pacientes con condiciones cardiacas
subyacentes que hubieran sido sometidos a procedimientos que causan bacteremia sobre
la base de los siguientes factores:
1.
Bacteremia
causa endocarditis
2.
los
estreptococos viridans son parte normal de la flora oral y los enterococos son
parte de la flora normal de los tractos GU y GI.
3.
esos
microorganismos usualmente fue ron susceptibles a los antibióticos recomendados
para profilaxis.
4.
La
profilaxis con antibióticos previene la endocarditis experimental en animales
causada por estreptococo viridans o por enterococos
5.
un
gran número de reportes de casos deficientemente documentados implicaban un
procedimiento dental como causa de EI
6.
en
algunos casos, hubo una relación temporal entre
un procedimiento dental y el inicio de los
síntomas de EI
7.
el
conocimiento de que la bacteremia causada por estreptococo viridans está
asociada con procedimientos dentales existe.
8.
el riesgo de reacciones adversas significativas
a un antibiótico es bajo en un paciente individual
9.
la
morbilidad y mortalidad por EI son altas. La mayoría de estos factores
permanecen válidos, pero colectivamente no compensan por la falta de datos
publica dos que demuestran el beneficio de la profilaxis.
Procedimientos
dentales causantes de bacteremia
Existen
pocos datos acerca del riesgo de o prevención de EI asociada con procedimientos
del tracto GI o GU. Se realizó un análisis crítico para recomendar la
profilaxis con antibióticos para EI antes de un procedimiento dental.
Se
consideraron los siguientes factores:
1. Frecuencia,
naturaleza, magnitud y duración de la bacteremia asociada con un procedimiento
dental.
La bacteremia transitoria es común con la manipulación de
los dientes y tejidos periodontales y hay una amplia variación en las
frecuencias reportadas de bacteremia en pacientes sometidos a procedimientos
dentales: extracción dental (10 a 100%), cirugía periodontal (36 a 88%); remoción
de placa dental y de cálculo periodontal (8 a 80%), limpieza dental (hasta 40%)
colocación de dique de goma/cuñas para procedimientos dentales (9 a 32%) y
procedimientos de endodoncia (hasta 20%).
La bacteremia transitoria también ocurre frecuentemente durante
las actividades de la vida diaria no relacionadas a un procedimiento dental,
tales como cepillarse los dientes o utilizar hilo dental (20 a 68%), uso de
palillos de madera (20 a 40%) utilización de dispositivos de irrigación de agua
(7 a 50%) y masticar los alimentos (7 a 51%).
Ha habido un foco desproporcionado en la frecuencia de bacteremia
asociada con procedimientos dentales más que con las especies de bacteria
recuperadas de los cultivos sanguíneos. Los estudios sugieren que más de 700 especies
de bacterias, incluyendo microorganismos aeróbicos y anaeróbicos Gram-positivos
y Gram-negativos, pueden ser identificados en la cavidad oral humana,
particularmente en los dientes y en los intersticios gingivales. Aproximadamente
30% de la flora de los intersticios gingivales son estreptococos,
predominantemente del grupo viridans. De más de 100 especies bacterianas orales
recuperadas de los cultivos sanguíneos después de procedimientos dentales, las
más prevalentes son los estreptococos viridans, es la causa microbiológica más
común de la EI valvular nativa adquirida en la comunidad en usuarios de drogas
no-intravenosas. En bocas sanas, una delgada superficie del epitelio de la
mucosa previene a bacterias potencialmente patogénicas de entrar en el torrente
sanguíneo y en el sistema linfático. Los microorganismos anaerobios son
comúnmente responsables de enfermedad periodontal y frecuentemente entran en el
torrente sanguíneo, pero raramente causan EI. Los estreptococos viridans son
antagonistas de los patógenos periodontales y predominan en bocas sanas y
saludables.
La magnitud de la bacteremia resultante de un procedimiento
dental es relativamente baja (< 104 unidades formadoras de colonias de
bacterias por mililitro) similares a lo que resulta de las actividades de la
vida diaria y es menos de la que se utiliza para causar EI experimental en animales
(106 a 108 unidades formadoras de colonias de bacterias por mililitro). Aunque
la dosis infecciosa requerida para causar EI en humanos es desconocida, el
número de microorganismos presentes en la sangre después de un procedimiento
dental o asociado con las actividades de la vida diaria es bajo. Los casos de EI
causadas por una bacteria oral, probablemente resulten de la exposición a una
baja inoculación de bacterias en el torrente circulatorio que resultan de
actividades de la vida diaria y no de un procedimiento dental.
El rol de duración de la bacteremia en el riesgo de adquirir
EI es incierto. Intuitivamente, parece
lógico asumir que a mayor duración de la bacteremia, es mayor el riesgo de EI,
pero no hay estudios publicados que apoyen este supuesto.
2. Impacto
de la enfermedad dental, higiene oral y tipo de procedimiento dental en la bacteremia
En pacientes con higiene oral deficiente, la frecuencia de
cultivos sanguíneos positivos inmediatamente antes de la extracción dental
puede ser similar a la frecuencia después de la extracción.
Una determinación precisa del riesgo relativo de bacteremia
que resulta de un procedimiento dental específico en pacientes con o sin
enfermedad dental probablemente no es posible.
No
es claro cuáles procedimientos dentales son más o menos probables de causar
bacteremia transitoria o resultar en una bacteremia de gran magnitud que la que
resulta de actividades de la vida diaria tales como masticar comida, cepillarse
los dientes o utilizar el hilo dental.
En
pacientes con condiciones cardiacas subyacentes, la terapia permanente con
antibióticos no se recomienda para prevenir la EI que podría resultar de
bacteremias asociadas con actividades de la vida diaria. En pacientes con
enfermedad dental, se enfoca acerca de la frecuencia de la bacteremia para la
prevención de EI y ha resultado en un sobreénfasis en la profilaxis con antibióticos
y en un subénfasis en mantener una buena higiene oral y acceder a cuidado
dental rutinario, los cuales son probablemente más importantes en reducir el
riesgo permanente de por vida de EI que la administración de antibióticos
profilácticos para un procedimiento dental.
3. Impacto
de la terapia con antibióticos en la bacteremia, secundaria a un procedimiento dental
Algunos
estudios reportaron que los antibióticos administrados antes de un
procedimiento dental reducen la frecuencia, naturaleza y/o duración de la bacteremia,
mientras otros no. Estudios recientes sugieren que la terapia con amoxicilina
tiene un impacto estadísticamente significativo en reducir la incidencia, naturaleza
y duración de la bacteremia de procedimientos dentales, pero no elimina la
bacteremia.
Sin
embargo, no hay datos que muestren que tal reducción como resultado de la
terapia con amoxicilina reduce el riesgo de o previene la EI. Hall y
colaboradores reportaron que ni la penicilina V ni la terapia con amoxicilina fueron
efectivas en reducir la frecuencia de bacteremia comparada con sujetos del
grupo control sin tratamiento.
En
pacientes sometidos a extracción dental, la terapia con penicilina o
ampicilina, comparada con placebo, disminuyó el porcentaje de estreptococos
viridans y de anaerobios en cultivo, pero no hubo diferencia significativa en
el porcentaje de pacientes con cultivos positivos después de 10 minutos de la
extracción dental.
En
un estudio separado, Hall y colaboradores reportaron que los pacientes tratados
con cefaclor no tuvieron una reducción en la bacteremia posprocedimiento, comparado
con los sujetos control que no recibieron tratamiento.
Finalmente,
los resultados son contradictorios en relación a la eficacia del uso de
antisépticos tópicos en reducir la frecuencia de bacteremia asociada a
procedimientos dentales, pero la preponderancia de la evidencia sugiere que no
hay un beneficio claro. Un estudio reportó que los enjuagues bucales con
clorhexidine y con yodopovidona fueron efectivos, mientras otros no mostraron
beneficio estadísticamente significativo.
Los
enjuagues antisépticos tópicos no penetran más allá de 3 mm en la bolsa
periodontal y por tanto no alcanzan las áreas de tejido ulcerado en donde las
bacterias más a menudo acceden al torrente circulatorio. En base a estos datos,
es improbable que los antisépticos tópicos sean efectivos en reducir
significativamente la frecuencia, magnitud y duración de la bacteremia asociada
con un procedimiento dental.
Condiciones
cardiacas asociadas con el más alto riesgo de resultado adverso de endocarditis
Los avances en la terapia antimicrobiana, el
reconocimiento temprano y el manejo de complicaciones de EI, y la mejoría en la
tecnología quirúrgica han reducido la morbilidad y la mortalidad de EI.
Numerosos factores comórbidos, tales como vejez, diabetes mellitus, condiciones
inmunodeprimidas o terapia, y deterioro funcional progresivo, lo que resulta en
la necesidad de su reposición.
En EI nativa secundaria a estreptococo viridans o a enterococos,
el espectro de la enfermedad puede variar de una infección relativamente benigna
a una severa disfunción valvular, dehiscencia, insuficiencia cardiaca
congestiva, eventos embólicos múltiples y muerte; sin embargo las condiciones
subyacentes mostradas en el cuadro III virtualmente siempre tienen un mayor
riesgo de resultado adverso.
Múltiples
series y revisiones han reportado que la presencia de material prostético y de
enfermedad cardiaca cianótica compleja en pacientes de muy corta edad (recién
nacidos y niños menores de dos años de edad) son los dos factores asociados con
los peores pronósticos de EI.
Se recomienda la profilaxis para
procedimientos dentales para estos pacientes durante los primeros 6 meses
después del procedimiento. En estos pacientes, la endotelización del material
prostético o de los dispositivos ocurre
dentro de 6 meses después del procedimiento.
No
se recomienda la profilaxis para procedimientos dentales más de 6 meses después
del procedimiento, una vez que es evidente que no hay defecto residual de la
reparación. En la mayoría de los casos, el tratamiento de los pacientes quienes
tienen materiales prostéticos infectados requiere remoción quirúrgica además de
la terapia médica asociadas con altas tasas de morbilidad y de mortalidad.
¿Debe
la profilaxis de EI ser recomendada para pacientes con el más alto riesgo de adquisición
de EI o para pacientes con el más alto riesgo de resultado adverso de la EI?
En
un alejamiento mayor de las Guías anteriores de la AHA, el Comité no recomienda
más la profilaxis de EI basada únicamente en un riesgo de por vida incrementado
de adquisición de EI.
Si
la profilaxis es efectiva, dicha terapia deberá ser restringida a aquellos pacientes
con el riesgo más alto de un resultado adverso de EI y quienes tendrán el mayor
beneficio por la prevención de EI.
Finalmente,
la administración de antibióticos profilácticos no está libre de riesgos, promueve la emergencia de microorganismos
resistentes que muy probablemente causan endocarditis, tales como estreptococos
del grupo viridans y enterococos. La frecuencia de resistencia a multidrogas de
los estreptococos viridans y de los enterococos se ha incrementado
dramáticamente durante las pasadas dos décadas. Esta resistencia incrementada
ha reducido la eficacia y el número de antibióticos disponibles para el
tratamiento de EI.
Regímenes
recomendados
·
Principios generales
Un antibiótico para profilaxis se debe administrar en una dosis
única antes del procedimiento. Si la dosis del antibiótico inadvertidamente
no es administrada antes del procedimiento, entonces la dosis se puede
administrar hasta 2 horas después del procedimiento. Sin embargo, la
administración de la dosis después del procedimiento debe ser considerada
solamente cuando el paciente no recibió la dosis pre-procedimiento. Algunos
pacientes quienes están programados para un procedimiento invasivo pueden tener
endocarditis coincidental. La presencia de fiebre u otras manifestaciones de
infección sistémica deben alertar al proveedor de la posibilidad de EI. En
estas circunstancias es importante obtener cultivos de sangre y otras pruebas
relevantes antes de la administración de antibióticos para prevenir la EI. La
falla para realizar esto puede resultar en retraso en el diagnóstico o
tratamiento de un caso concomitante de EI.
Regímenes
para procedimientos dentales
Las Guías anteriores de la AHA sobre la profilaxis listaban un
número sustancial de procedimientos dentales y de eventos para los cuales la
profilaxis con antibióticos era recomendada y aquellos procedimientos para los
cuales la profilaxis no era recomendada. Tomando como base una revisión crítica
de los datos publicados, es claro que la bacteremia transitoria por
estreptococo viridans, puede resultar de cualquier procedimiento dental que
involucra la manipulación de la región gingival o periapical de los dientes o
perforación de la mucosa oral. No se puede asumir que la manipulación de una
boca en apariencia sana o que un procedimiento invasivo dental mínimo reduce la
probabilidad de bacteremia. Por tanto, la
profilaxis con antibióticos es recomendada para pacientes con las condiciones
enlistadas en el cuadro III, quienes son sometidos a algún procedimiento dental
que involucra los tejidos gingivales o la región periapical de un diente y para
aquellos procedimientos que perforan la mucosa oral . Aunque la profilaxis
de EI puede ser razonable para estos pacientes, su efectividad es desconocida (Class
IIB, LOE C) esto incluye los procedimientos, tales como: biopsias, remoción de
suturas y colocación de bandas ortodónticas, pero no incluye las inyecciones rutinarias
de anestesia a través de tejido no infec-tado, tomar radiografías dentales,
colocar dispositivos ortodónticos o prostodónticos removibles, colocación de brackets
ortodónticos o ajuste de dispositivos ortodónticos.
Finalmente
hay otros eventos que no son procedimientos dentales y para los cuales la
profilaxis no es recomendada, tales como la remoción de los dientes de leche y
traumas a los labios y mucosa oral.
En
esta limitada población de pacientes, la terapia profiláctica antimicrobiana
debe ser dirigida contra el grupo del estreptococo viridans. Durante las
pasadas dos décadas, ha habido un incremento significativo en el porcentaje de
cepas de estreptococo viridans resistentes a los antibióticos recomendados en
las Guías previas de la AHA para la prevención de la EI. Prabhu y cols135
estudiaron los patrones de susceptibilidad del grupo de estreptococo viridans
recuperado de pacientes con EI diagnosticada durante el periodo comprendido
entre 1971 y 1986 y compararon estas susceptibilidades con aquéllas de los
estreptococos viridans de pacientes con EI diagnosticados de 1994 a 2002. La
mayoría de las cepas del estreptococo viridans en los estudios mencionados
anteriormente fueron recuperadas de pacientes con serias enfermedades
subyacentes, incluyendo enfermedades malignas y neutropenia febril.
La amoxicilina es la elección preferida
para la terapia oral porque es bien absorbida en el tracto gastrointestinal y
proporciona concentraciones séricas altas y sostenidas.
Para individuos que son alérgicos a la penicilina o amoxicilinas, el uso de cefalexina
o de otra cefalosporina oral de primera generación, clindamicina, azitromicina
o claritromicina es recomendado. Aun cuando la cefalexina fue menos activa contra
el estreptococo viridans que otras cefalosporinas orales de primera generación
en un estudio, la cefalexina es incluida en el cuadro V. No hay datos que muestren
la superioridad de una cefalosporina oral sobre otra para la prevención de EI,
y la cefalexina genérica es ampliamente disponible y relativamente económica.
Debido
a las posibles reacciones cruzadas, una cefalosporina no debe ser administrada
a pacientes con antecedente de anafilaxis, angioedema o urticaria después del
tratamiento con alguna forma de penicilina, incluyendo ampicilina o
amoxicilina. Los pacientes quienes son incapaces de tolerar un antibiótico oral
pueden ser tratados con ampicilina, ceftriaxona, o cefazolina administrada intramuscular
o intravenosa. Para pacientes alérgicos a la ampicilina quienes no son capaces
de tolerar un agente oral, la terapia recomendada es cefazolina, ceftriaxona o
clindamicina
PACIENTES CON ANTICOAGULANTES:
Las inyecciones intramusculares para
profilaxis de EI deben ser evitados en pacientes quienes están recibiendo terapia
con anticoagulantes (Clase I, LOE A) en estas circunstancias, los regímenes
administrados oralmente deben ser dados cuando sea posible. Los antibióticos
administrados por vía intravenosa deben ser utilizados para pacientes quienes
son incapaces de tolerar o absorber medicamentos orales.
Con esto se concluye que como
responsables de la salud es importante que conozcamos los riesgos de una de las
enfermedades que podríamos causar, así mismo como el tratamiento o la manera en
que se puede prevenir como lo es en este caso con la profilaxis antibacteriana
1 hora antes del procedimiento. Este pequeño paso que muchas
veces se omite podría salvar la vida de muchos de nuestros pacientes y de ahí de
nuevo se retoma la importancia de que se tenga conocimiento sobre la
Endocarditis Infecciosa.
BIBLIOGRAFIA:
- Prevención de endocarditis infecciosa. Guías de la American Heart Association.
- Espinosa-Meléndez M.T. “Farmacología y Terapéutica para Odontólogos. y Guía práctica” Ed. Médica Panamericana. México 2012
Suscribirse a:
Comentarios (Atom)